人工复苏器注册技术审查指导原则(2019年第79号)
本指导原则旨在指导注册申请人对人工复苏器(俗称:简易呼吸器)注册申报资料的准备及撰写,指导和规范人工复苏器的技术审评工作,帮助审评人员理解和掌握该类产品结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。
本指导原则所确定的核心内容是在目前的科学认知水平和产品技术基础上形成的。因此,注册申请人和审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。注册申请人和审评人员需密切关注相关法规的变化,确认申报产品是否符合法规要求。
适用范围
本指导原则适用于人工复苏器,该产品用于实施人工呼吸、急救时提供肺通气。根据《医疗器械分类目录》(国家食品药品监督管理总局公告2017第104号),人工复苏器的管理类别为二类,分类编码为08—03—05(呼吸、麻醉和急救器械—急救设备—人工复苏器(人工复苏器))。
本指导原则范围不适用电动、气动复苏器。
技术审查要点
产品名称要求
人工复苏器产品命名应符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)、《医疗器械分类目录》和行业标准中的通用名称,如“人工复苏器”、“简易呼吸器”。
产品的结构和组成
人工复苏器通常由病人阀(可含限压阀)、呼吸球囊、进气阀组组成。可根据不同的使用要求配置各种相应的选配件,如面罩、氧气管、储气袋或储气管等。按照使用次数可以分为可重复使用、一次性使用产品。产品结构示意图如下:
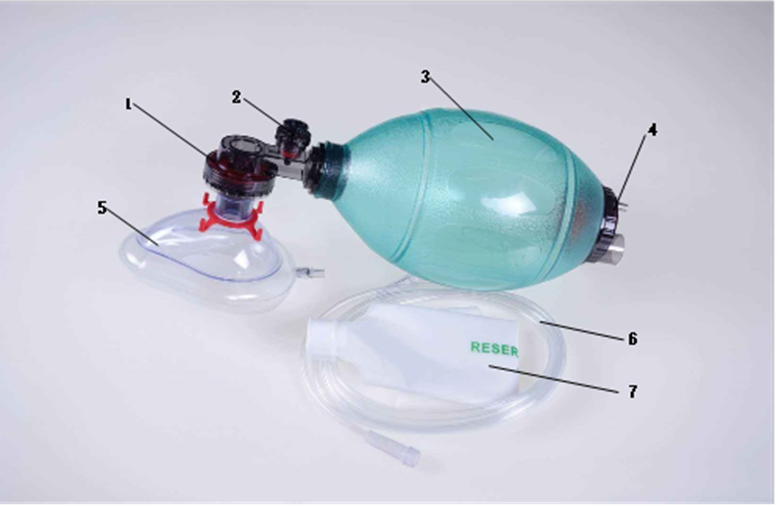
1-病人阀 ; 2-限压阀; 3-呼吸球囊; 4-进气阀组;5-面罩(选配); 6-氧气管(选配); 7-储气袋(选配)
图1 人工复苏器示意图
产品工作原理/作用机理
人工复苏器产品主要用于实施人工呼吸、急救时提供肺通气。使用时,按压呼吸球囊,进气阀组关闭,气体经病人阀端进入患者呼吸道;释放呼吸球囊,病人阀关闭,在压力差作用下,外界空气经进气阀组进入球囊。当需要高浓度氧气输送时,复苏器连接氧气管、储气袋或储气管使用,通过氧气管接头连接氧气源,储气袋充满氧气后,过量氧气通过进气阀组排出到空气中。
注册单元划分的原则和实例
人工复苏器注册单元原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据。
例:一次性使用人工复苏器和重复使用人工复苏器划分为不同注册单元;无菌人工复苏器和非无菌人工复苏器划分为不同注册单元。
产品适用的相关标准
如表1列出人工复苏器主要涉及的现行有效的国家/行业标准、国际标准;如有标准发布或更新,应当考虑新版标准的适用性。
表1 产品适用标准(统一格式,标准编号)
| 标准编号 | 标准名称 |
| GB/T 191—2008 | 包装储运图示标志 |
| GB 18280.1-2015 | 医疗保健产品灭菌 辐射 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求 |
| GB 18280.2-2015 | 医疗保健产品灭菌 辐射 第2部分:建立灭菌剂量 |
| GB/T 18280.3-2015 | 医疗保健产品灭菌 辐射 第3部分:剂量测量指南 |
| GB 18279.1-2015 | 医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求 |
| GB/T 18279.2-2015 | 医疗保健产品的灭菌 环氧乙烷 第2部分:GB 18279.1应用指南 |
| GB/T 19633.1-2015 | 最终灭菌医疗器械包装 第1部分:材料、无菌屏障系统和包装系统的要求 |
| GB/T 19633.2-2015 | 最终灭菌医疗器械包装 第2部分:成形、密封和装配过程的确认的要求 |
| GB/T 14233.1-2008 | 医用输液、输血、注射器具检验方法第1部分:化学分析方法 |
| GB/T 14233.2-2005 | 医用输液、输血、注射器具检验方法第2部分:生物学试验方法 |
| GB/T 16886.1-2011 | 医疗器械生物学评价 第1部分:风险管理过程中的评价与试验 |
| GB/T 16886.5-2017 | 医疗器械生物学评价 第5部分:体外细胞毒性试验 |
| GB/T 16886.7-2015 | 医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量 |
| GB/T 16886.10-2017 | 医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验 |
| GB/T 16886.12-2017 | 医疗器械生物学评价 第12部分:样品制备与参照样品 |
| YY/T 0287-2017 | 医疗器械质量管理体系用于法规的要求 |
| YY/T 0313-2014 | 医用高分子产品包装和制造商提供信息的要求 |
| YY/T 0316-2016 | 医疗器械风险管理对医疗器械的应用 |
| YY/T 0466.1-2016 | 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求 |
| YY/T 1474-2016 | 医疗器械可用性工程对医疗器械的应用 |
| YY 0600.4-2013 | 医用呼吸机 基本安全和主要性能专用要求 第4部分:人工复苏器 |
| YY/T 1040.1-2015 | 麻醉和呼吸设备 圆锥接头 第1部分:锥头与锥套 |
| GB/T 1962.1-2015 | 注射器、注射针及其他医疗器械用6%(鲁尔)圆锥接头 第1部分:通用要求 |
| ISO 18562-1:2017 | Biocompatibility evaluation of breathing gas pathways in healthcare applications — Part 1: Evaluation and testing within a risk management process |
| / | 中华人民共和国药典(2015版) |
上述标准包括了产品研发及注册申报资料中经常涉及的标准。不包括根据产品的特点所引用的一些行业外标准或其他标准。
产品适用及引用标准的审查可以分两步来进行。首先对引用标准的齐全性和适宜性进行审查,也就是审查产品技术要求中与产品相关的国家标准、行业标准是否进行了引用,以及引用是否准确。应注意引用标准的编号、名称是否完整规范,年代号是否有效。其次对引用标准的采纳情况进行审查。即所引用的标准中的条款要求,是否在产品技术要求中进行了实质性的条款引用。这种引用通常采用两种方式,文字表述繁多内容复杂的可以直接引用标准及条文号,比较简单的也可以直接引述具体要求。
产品的适用范围/预期用途
用于供电供气不完备场合和紧急情况下对突发呼吸困难或呼吸衰竭的患者实施人工呼吸、急救时提供肺通气。
产品的主要风险
1. 产品的风险管理报告应符合YY/T 0316-2016《医疗器械风险管理对医疗器械的应用》的有关要求,判断与产品有关的危险,估计和评价相关风险,控制这些风险并监视控制的有效性。注册申请人提供注册产品的风险管理报告应扼要说明:
(1)在产品的研制阶段,已对其有关可能的危险及产生的风险进行了估计和评价,并有针对性地实施了降低风险的技术和管理方面的措施。
(2)在产品性能测试部分中验证了这些措施的有效性,达到了通用和相应专用标准的要求。
(3)对所有剩余风险进行了评价。
(4)风险/受益分析。
(5)对产品的安全性的承诺。
2. 风险管理报告的内容至少包括:
(1)产品的风险管理组织。
(2)产品的组成及适用范围。
(3)风险报告编制的依据。
(4)产品与安全性有关的特征的判定。
注册申请人应按照YY/T 0316-2016《医疗器械风险管理对医疗器械的应用》附录C的34条提示,对照产品的实际情况作出针对性的简明描述。
注意:产品如存在34条提示以外的可能影响安全性的特征,也应作出说明。
(5)对产品的可能危险、可预见的事件序列和危险情况的判定。
注册申请人应根据自身产品特点,根据YY/T 0316-2016附录E、I的提示,对危险、可预见的事件序列、危险情况及可发生的伤害作出判定。
(6)风险可接受准则:降低风险的措施及采取措施后风险的可接受程度,是否有新的风险产生。
(7)风险控制的方案与实施、综合剩余风险的可接受性评价及生产和生产后监视的相关方法,可参考YY/T 0316-2016的附录F、G、J。
表2 产品主要初始危险因素
| 通用类别 | 初始事件和环境示例 |
| 不完整的要求 | 性能要求不符合。 与人体直接接触部件材料的生物相容性问题。 说明书未对人工复苏器的使用操作方法进行准确的描述与说明。 货架有效期不恰当规范:在标识的有效期前,已无法保证产品的性能要求。 |
| 制造过程 | 制造过程的控制不充分:生产过程关键工序控制点未进行监测,导致人工复苏器不合格。 供方的控制不充分:外购、外协件供方选择不当,外购、外协件未进行有效进货检验,导致不合格外购、外协件投入生产。 |
| 运输和贮藏 | 不恰当的包装:产品防护不当导致产品运输过程中损坏。 不适当的环境条件:产品存放于极端恶劣的环境条件中,如不干净的仓库,长时间高温/低温、高湿的环境,造成产品受到污染。 |
| 清洁、消毒和 灭菌 | 消毒执行不恰当:未对产品消毒工艺进行确认或未按照确认过的参数进行消毒,导致消毒不彻底,产品有污染。 灭菌执行不恰当:未按要求对人工复苏器进行灭菌,或未达到灭菌效果。 重复使用次数超过经验证的次数。 |
| 处置和废弃 | 没提供信息或提供信息不充分:未在使用说明书中对产品处置和废弃方法进行说明,或信息不充分 |
| 材料 | 生物相容性:与人体接触的工具部分或其他部件选择不当可致过敏等反应。 阀门老化,密封性能问题 |
| 人为因素 | 易混淆的或缺少使用说明书:如缺少详细的使用方法、缺少必要的警告说明;使用不适当的型号;操作说明过于复杂,不易懂。 由缺乏技术的/未经培训的人员使用:使用者/操作者未经培训或培训不足,不能正确使用人工复苏器。 |
表3 部分危险、可预见的事件序列、危险情况和可发生的伤害之间的关系
| 危险 | 可预见的事件序列 | 危险情况 | 伤害 |
| 化学的 | 生产过程使用了加工助剂,注塑过程使用了工业脱模剂等,产品清洁不完全。 | 带有化学残留的产品使用于人体。 | 刺激患者中毒,引起炎症,伤害人体健康。 |
| 生物学的 (微生物污染) | 消毒或灭菌效果不佳;初始污染菌超标。 | 有微生物污染的器械使用于人体 | 交叉使用,感染患者,进而感染与患者接触的人员 |
| 生物相容性 | 产品无良好的生物相容性; | 与人体组织不相容的器械使用于人体 | 中毒、刺激、过敏等症状,伤害患者健康,严重时危及患者生命。 |
| 功能 | 进气阀漏气,无法提供足够的输送容量;病人阀阻塞,气体无法正常输送至患者口中;一次性使用的产品被重复使用。 | 无法提供有效的肺通气;未进行消毒灭菌或消毒灭菌后产品性能无法满足性能要求。 | 错失最佳 呼吸抢救时间;交叉感染或无法提供有效肺通气。 |
表2、表3依据YY/T 0316-2016的附录E提示性列举了人工复苏器可能存在危险的初始事件和环境,示例性地给出了危险、可预见的事件序列、危险情况和可发生的伤害之间的关系,给审查人员予以提示、参考。
由于人工复苏器功能和结构的差异,本章给出的风险要素及其示例是常见的而不是全部的。上述部分只是风险管理过程的组成部分,不是风险管理的全部。注册申请人应按照YY/T 0316-2016中规定的过程和方法,在产品整个生命周期内建立、形成文件和保持一个持续的过程,用以判定与医疗器械有关的危险、估计和评价相关的风险、控制这些风险并监视上述控制的有效性,以充分保证产品的安全和有效。
产品的研究要求
1. 产品性能研究
应详述产品技术要求中主要性能指标及检验方法的确定依据,提供采用的原因及理论基础,提供涉及的研究性资料、文献资料和标准文本。如适用的国家标准、行业标准中有不采纳的条款,应将不采纳的条款及其理由予以阐明。
应研究的产品基本性能至少包括进气阀接头、拆卸与装配、被呕吐物污染的患者阀功能、机械冲击、增补氧和输送的氧浓度、呼气阻抗、吸气阻抗、死腔、最小输送容量、压力限制、微生物限度等。
说明书中描述的性能或产品宣称的特殊性能应进行研究。
若产品带有配合使用的配件,应分别列出附件的材料、结构、性能要求。
应提供产品的主要原材料选择依据等信息。
2. 生物相容性的评价研究
应描述人工复苏器产品与人体接触部件的材料,以及在使用过程中与皮肤组织接触的性质和时间,参照《关于印发医疗器械生物学评价和审评指南的通知》(国食药监械〔2007〕345号)、GB/T 16886.1—2011的要求对其进行生物相容性评价。
建议参照ISO 18562-1-2017,对与人体间接接触的部件进行生物相容性评价研究。
3. 消毒或灭菌工艺研究
应明确灭菌工艺(方法和参数)和无菌保证水平(SAL),并提供灭菌确认报告。若灭菌使用的方法容易出现残留,如环氧乙烷灭菌,应当明确残留物信息及采取的处理方法,并提供研究资料。可根据适用情况,按照GB 18280.1-2015、GB18280.2-2015、 GB 18279.1-2015、GB/T 18279.2-2015等标准的要求开展研究。
对于重复使用的产品,应提供终端用户灭菌或消毒方面的研究资料,包括重复灭菌或消毒次数、产品性能的研究。
对于使用前需要进行清洗、消毒或灭菌的,应当明确推荐的消毒或灭菌工艺(方法和参数)以及所推荐消毒/灭菌方法确定的依据。
4. 产品有效期和包装研究
(1)产品有效期和包装研究情况可通过实时老化或加速老化试验获得。有效期研究项目包含包装完整性和技术要求中规定的项目,建议选择原材料最多,组件最完整,使用性能可以覆盖使用单元的型号进行验证。加速老化试验可参照YY/T 0681.1—2009《无菌医疗器械包装试验方法 第1部分:加速老化试验指南》系列标准、GB/T 19633.1—2015《最终灭菌医疗器械包装 第1部分:材料、无菌屏障系统和包装系统的要求》、GB/T 19633.2—2015《最终灭菌医疗器械包装 第2部分:成形、密封和装配过程的确认的要求》、YY/T 0698.1—2011《最终灭菌医疗器械包装材料 第1部分:吸塑包装共挤塑料膜要求和试验方法》系列标准等进行;非无菌供应的产品可参考上述标准进行有效期研究。
(2)申请人应提交包装研究资料,依据有关国内、国际标准(如GB/T 19633.1-2015、GB/T 19633.2-2015、ISO 11607-1等)对包装进行分析研究和评价。直接接触产品的包装材料的选择应至少考虑以下因素:包装材料的物理化学性能;包装材料的毒理学特性;包装材料与产品的适应性;包装材料与成型和密封过程的适应性;包装材料与灭菌过程的适应性;包装材料所能提供的物理、化学和微生物屏障保护;包装材料与使用者使用时的要求(如无菌开启)的适应性;包装材料与标签系统的适应性;包装材料与贮存运输过程的适应性;非无菌供应的产品,可参考上述适用的项目进行包装研究。
产品技术要求应包括的主要性能指标
人工复苏器产品有直接对应的行业标准YY 0600.4-2013《医用呼吸机 基本安全和主要性能专用要求 第4部分:人工复苏器》,对产品本身明确了要求。不同企业可根据自身产品的技术特点制定性能指标要求,但不得低于相关强制性标准的强制性要求、说明书中描述的性能或产品宣称的特殊性能应进行研究。
物理性能:
1. 患者连接口接头
2. 呼吸气体的呼气口接头
3. 面罩接头
4. 气囊充气阀接头
5. 气囊进气阀接头
6. 螺纹气体过滤器接头
7. 氧气管接头和压力计接头
8. 操作要求
8.1 拆卸和装配
8.2 被呕吐物污染后的患者阀功能
9. 机械冲击
9.1 坠落试验
9.2 浸水
9.3 气囊充气阀
10. 增补氧和输送的氧浓度
11. 呼气阻抗
12. 吸气阻抗
13. 患者阀故障
14. 患者阀泄漏—前向泄漏
15. 人工复苏器死腔和重复呼吸
16. 通气性能
16.1最小输送容量
16.2 压力限制
17. 储存和操作条件
18. 压力限制系统设置的指示。
19. 外观要求。
20. 若产品包含其他配合使用的附件,应结合产品功能、结构制定相关性能要求。例如,储气袋性能要求(接头、容量、外观、气密性)。
21. 化学性能
根据不同材料特性,由申请人决定是否对化学性能提出要求。跟人体直接接触的部件,应补充化学性能的要求(至少pH值、重金属)。
22. 生物性能
22.1 非无菌供应的产品,若产品首次使用前不需要进行清洗、消毒、灭菌处理,鼓励申请人对微生物限度进行规定。
22.2 以灭菌包装提供的产品应无菌。
22.3 采用环氧乙烷灭菌的产品,环氧乙烷残留量不得大于10μg/g。
检测单元中典型产品的确定原则和实例
同一注册单元应按产品风险与技术指标的覆盖性来选择典型产品。典型产品应是同一注册单元内能够代表本单元内其他产品安全性和有效性的产品,应考虑功能最齐全、结构最复杂、原材料最多的产品,若不能完全覆盖,还应选择其他型号进行差异性检验。例如:病人阀、进气阀结构不同的,应分别进行检验。
产品生产制造相关要求
1. 应当明确人工复苏器生产工艺流程,注明关键工序和特殊过程,并说明其过程控制点。
2. 有多个研制、生产场地,应当概述每个研制、生产场地的实际情况,相关的生产环境应符合《医疗器械生产质量管理规范》(国家食品药品监督管理总局公告2014年第64号)的相关要求和YY/T 0287—2017的相关要求。
产品的临床评价要求
按照《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号)提交临床评价资料。
与《免于进行临床试验的医疗器械目录(修订)》(国家药品监督管理局通告2018年第94号,以下简称《目录》)中,序号为340“人工复苏器(人工复苏器)”相同的产品可免于进行临床试验。申请人需提交申报产品相关信息与《目录》所述内容的对比资料和申报产品与已获准境内注册的《目录》中医疗器械的对比说明。
若无法证明申报产品与《目录》产品具有等同性,则应按照《医疗器械临床评价技术审查指导原则》及其他临床评价法规文件的要求开展相应工作,提供符合要求的临床评价资料。
产品的不良事件历史记录
暂未查询到人工复苏器临床使用出现不良事件的信息。
产品说明书和标签要求
产品说明书、标签的编写要求应符合《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)、YY/T 0466.1—2016、YY/T 0313—2014、YY 0600.4-2013等相关标准的要求。同时应注意以下要求。
1. 在所有预期操作模式下,如何操作人工复苏器的说明。
2. 每个型号适合使用的体重范围。
3. 操作环境、储存环境限制。
4. 除空气外,人工复苏器能输送的所有内容物。
5. 能输送的氧浓度。
6. 输送气体容量范围。
7. 人工复苏器死腔、前向泄漏和反向泄漏。
8. 呼气阻抗、吸气阻抗和使用推荐附件所加的阻抗。
9. 人工复苏器正常使用时产生的呼末压,如果大于0.2kPa,应说明。
10. 如果有压力限制系统和超控装置,应说明其详细信息。
11. 如果人工复苏器配有控制装置或指示装置,应说明其准确性。
12. 为了清洁而需拆卸和装配的说明,以及装配后进行操作的性能测试的详细说明。
13. 对人工复苏器、部件、配件进行清洁、消毒或灭菌的推荐方法。
14. 使用前需进行的功能测试。
15. 维护要求。
16. 在有害或有毒环境中使用的建议(如适用)。
17. 操作者可更换的部件清单。
18. 在高氧浓度条件下,烟和火会引起危险的警告,以及人工复苏器禁止使用油脂的警告。
19. 警告不正确的使用人工复苏器会造成危险。
20. 一次性使用产品应当注明是“一次性使用”或“禁止重复使用”字样或符号。
21. 产品使用后需要处理的,应当标明相应的处理办法。
22. 有限次重复使用的产品应注明可供使用的次数和建议的消毒或灭菌方式。
23. 明确本产品为一次性使用或仅限同一个人使用,若仅限同一个人使用应描述其风险及处理方法。
审查关注点
(一)重点关注产品技术要求编写的规范性,引用标准的适用性、准确性、有效性,是否结合产品所含的选配件制定相应的性能指标。
(二)重点关注注册申请人的产品研究资料是否全面、准确,是否体现其安全性、有效性。
(三)重复使用器械:技术审评时需特别关注重复使用次数的验证,清洗和消毒方法的确认。
(四)产品检验报告:应关注检测的典型型号是否覆盖所有性能要求,检验报告所附照片中的产品结构组成、标识标签等信息,是否与其他申报资料描述相同。
(五)对说明书的审查应注意明确产品的信息,选配件应列明并表述正确。
